Относително атомно и молекулно тегло
Съдържание

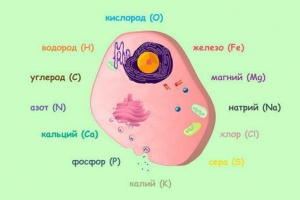
Една от най -важните характеристики на всяка молекула и всеки атом е неговата маса. В химията е обичайно да се измерва не в килограми, а с помощта на SO -Called a. E. m. - Атомна единица на масата.
Как да определим масата на молекулата?
Въпреки че идеите, че всички вещества се състоят от най -малките частици, тоест атоми също са изразени от демократ в древността, беше невъзможно да се докаже подобни хипотези. В началото на XIX в. Настъпи научен пробив. Джон Далтън отвори три важни закона наведнъж:
- Законът за множество отношения;
- Законът на частичния натиск;
- Законът за разтворимост на газовете в течности.
Възможно е да се обяснят отворените модели само с помощта на хипотеза за атомната структура на веществото. Същите закони позволиха на Далтън да сравнява масите на атомите и молекулите помежду си. Ученият е взел масата на водороден атом на единица (тъй като той се оказа най -лекият атом) и чрез него (тоест чрез водородната единица) през 1803 г. изразява масите на много други атоми и молекули. Оказа се обаче, че значителна част от изчисленията са извършени с грешки.
По това време реакциите на образуването на оксиди, тоест кислородни съединения, най -често се използват за определяне на масите на атомите. Поради тази причина по време на експериментите всъщност масата на водородния атом, но като кислороден атом се използва като единица за измерване. Първоначално грубите изчисления показват, че кислородният атом е 16 пъти по -тежък от водороден атом, тоест неговата маса според цветната сляпа система е 16 единици. Тогава обаче се оказа, че въпреки това кислородният атом е по -тежък само 15.874 пъти. Тези данни изискват преизчисляване на всички ядрени маси. Но химиците действаха по -лесно - те се съгласиха, че сега масата на кислородния атом е приета точно 16 атомни единици. Така че имаше нови кислородни единици с атомно тегло. В резултат на това трябваше да се преизчисли само маса на водород - сега тя не беше единица, но 16: 15.874< 1.0079 Атомни единици.
Вече в началото на XX в. Оказа се, че изотопите могат да съществуват в природата - атомите на един и същи елемент, различни по маса. По -специално, в природата има три различни стабилни изотопа на кислорода (и 10 по -нестабилни). Възникна въпроса - масата на коя от тези изотопи ще бъде взета за единица? Физиците започнаха да използват масата на изотопния кислород-16 и химиците-средната маса на всички изотопи (като се вземат предвид тяхното разпространение в естествения кислород). Имаше несъответствия, които бяха разрешени едва през 1960-1961 г. Тогава е прието споразумение, че масата на въглеродния изотоп се приема равна на 12 атомни единици маса (a. E. m.). По този начин се появи въглеродна единица.
Моларна маса
В допълнение към молекулната маса има и моларна маса. Тя показва колко грам един мол претегля веществото. Всъщност моларната маса съвпада със стойността на молекулната маса, но тя се измерва в други стойности- в g/mol. Например, ако атомната маса на въглерод-12 е 12 a. E. m., тогава моларната му маса ще бъде 12 g/mol.
Каква е масата на един a. E. m.?
С помощта на атомните маси е удобно да се сравняват масата на атомите и сложните молекули помежду си помежду си. Например, ако водната молекула тежи 18 a. E. m., В молекула на въглероден диоксид - 44 a. E. m., това означава, че молекула с2 По -тежки от водните молекули в 44/18 ≈2,444 пъти. Но как да определим масата на атомите и молекулите в обичайните килограми?
Това може да стане чрез изчисляване на броя на авиадото, което показва колко молекули се съдържат в 1 молитва на веществото. Първите оценки на броя на Авиадо са извършени едва през 1865 г., Но след това учените бяха сбъркани 15 пъти, след 8 години грешката намалява с 10 пъти. Днешните измервания показват, че един водороден атом тежи само 1,66 • 10–27 килограма.
Обобщаване
За да се определи масата на атомите и молекулите. E. m. - Атомна единица на масата. Тя е 1/12 от масата на въглеродния изотоп атом 12 и приблизително 1,66 • 10–27 килограма.